Saiba qual é o papel dos animais nas coronaviroses humanas.

Os coronavírus pertencem à família Coronaviridae, que compreende um grupo de vírus envelopados com material genético sob a forma de RNA fita simples. Sua denominação “coronavírus” originou-se da aparência de suas partículas circundadas por uma “coroa”, observada à microscopia eletrônica. Os coronavírus possuem o maior material genético (26 a 32 kilobases) dentre todos os RNA vírus. Dois terços de seu genoma são submetidos à translação para a síntese de várias proteínas não estruturais que constituirão o complexo de transcrição-replicação.
O restante do genoma contém os genes responsáveis pela transcrição das proteínas estruturais: proteína S (espícula), proteína M (transmembrana), proteína N (nucleoproteína) e proteína E (envelope). Algumas proteínas acessórias também são sintetizadas. Baseado nas sequências destas proteínas esta família de vírus é subdividida em gêneros alfa, beta, gama e delta. Os coronavírus gêneros alfa e beta infectam mamíferos, enquanto os coronavírus incluídos em gama e delta infectam pássaros e peixes.
Por meio de análise filogenética, morcegos e roedores são reservatórios de alfa e beta-coronavírus, enquanto os pássaros, de gama e delta-coronavírus. Alguns coronavírus nestes reservatórios conseguiram ultrapassar a barreira da especificidade de hospedeiro e se tornaram patógenos capazes de infectar e causar doença no homem. Entenda melhor no esquema abaixo:
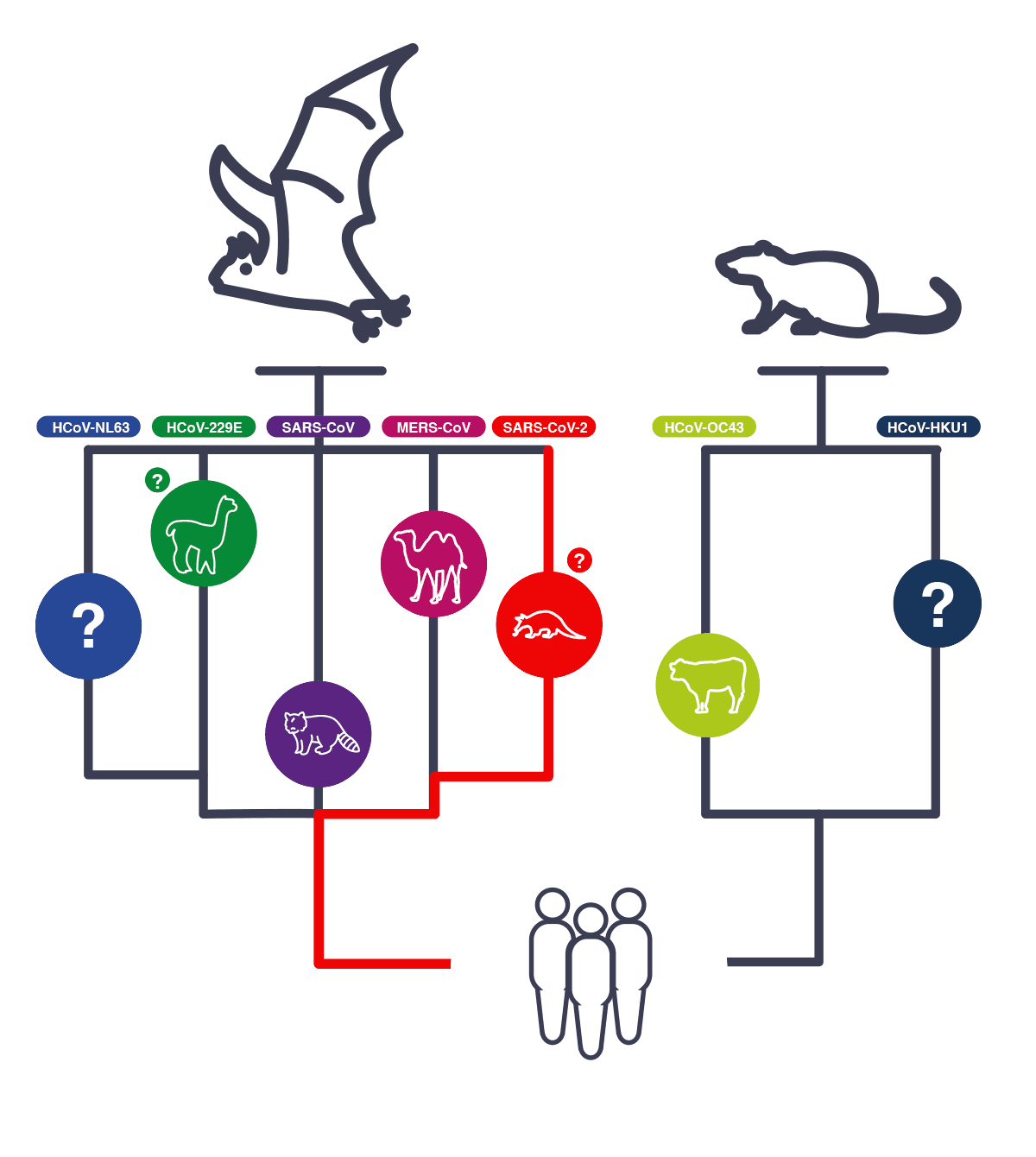
Até o momento, sete coronavírus humanos (HCoV) possuem origem zoonótica. Dois deles são alfa-coronavírus (HCoV-229E e HCoV-NL63), descobertos na década de 1960. Os outros cinco são do gênero beta: HCoV-OC43, HCoV-HKU1, SARS-CoV (Coronavírus – Síndrome Respiratória Aguda Grave, do inglês “Severe Acute Respiratory Syndrome Coronavirus”), MERS-CoV (Síndrome Respiratória do Oriente Médio – Coronavírus, do inglês “Middle East Respiratory Syndrome Coronavirus”) e SARS-CoV-2. O SARS-CoV foi descoberto em 2002 em Guangdong (China), sua epidemia resultou em um pouco mais de 8.000 casos com 916 mortes.
Os coronavírus humanos HCoV-OC43 e HCoV-HKU1 foram descobertos em 2004 e causam quadros brandos de resfriado. O MERS-CoV foi descoberto em 2014 e induz pneumonia aguda, e insuficiência renal aguda em maior frequência que os vírus SARSs-CoV. A infecção pelo MERS-CoV resultou em 2.254 casos com um pouco mais de 800 mortes. O novo coronavírus SARS-CoV-2 foi identificado inicialmente em dezembro de 2019 em um surto de pneumonia em pacientes humanos na cidade de Wuhan (China). A doença desencadeada pelo SARS-CoV-2 foi denominada de COVID-19, abreviação de “Coronavirus Disease 2019”. Até o momento (11/5/2020), contabilizou-se 4,1 milhões de infectados e 283.100 mortes por COVID-19.
Os seguintes coronavírus humanos HCoV-229E, HCoV-NL63, HCoV-OC43 e HCoV-HKU1 são responsáveis por quadros brandos de resfriado. Eles estão bem adaptados ao homem, sendo pouco provável que sofram mutação resultando em maior virulência, embora isso já tenha acontecido com uma cepa do HCoV-NL63, que induziu quadros graves de pneumonia. Desta forma, como eles circulam bem adaptados na população humana há muito mais tempo, eles não precisam de um reservatório animal. Por outro lado, o SARS-CoV, MERS-CoV e o SARS-CoV-2 são mais virulentos, podendo levar à síndrome do desconforto respiratório agudo e outras manifestações extrapulmonares como doença renal e acidente vascular cerebral.
Eles não estão bem adaptados ao homem e sua transmissibilidade entre as pessoas não é muito eficiente, necessitando assim de um reservatório animal para amplificar sua replicação. Isto parece não se aplicar ao SARS-CoV-2 que não teve seu reservatório animal identificado, suspeita-se do pangolim, como também sua transmissibilidade entre as pessoas é muito mais eficiente com menor taxa de mortalidade comparada ao SARS-CoV e ao MERS-CoV, no entanto, é mais virulento que os outros HCoVs (HCoV-229E, HCoV-NL63, HCoV-OC43 e HCoV-HKU1). Ainda é incerto que o SARS-CoV-2 se adaptará plenamente ao homem, sem a necessidade de um reservatório ou hospedeiro intermediário para circular entre as pessoas.
Os morcegos possuem características que os tornam excelentes disseminadores de vírus, tornando-os infectados com várias espécies de vírus, como uma ampla diversidade de coronavírus para recombinação genética e possibilidade de transmissão. Sua longevidade, interação social muito próxima entre os membros das colônias, como também a alta densidade das mesmas, aliado ao fato de serem excelentes voadores, criam uma situação ideal para o espalhamento do vírus.
Os hospedeiros intermediários para o SARS-CoV é uma civeta (Paguma larvata) e um cão-guaxinim (Nyctereutes procyonoides). Sugere-se que estes hospedeiros intermediários, que foram vendidos em mercados de animais vivos em Guangzhou (China), sejam amplificadores do vírus, porque não encontraram evidências da infecção pelo SARS-CoV em outros membros selvagens destas espécies. Vários coronavírus têm sido isolados de morcegos, e alguns deles com homologia na sequência de nucleotídeos de 88 a 95% ao SARS-CoV, sugerindo que os morcegos são os hospedeiros naturais do SARS-CoV. O mesmo raciocínio se aplica em relação ao MERS-CoV, onde se encontrou 87% de homologia em coronavírus de morcego. O MERS-CoV foi isolado das narinas de camelos dromedários soropositivos para MERS-CoV.
O vírus isolado destes animais era idêntico ao vírus humano, fato que torna os camelos dromedários hospedeiros intermediários perfeitos ao homem. Camelos infectados com o MERS-CoV desenvolvem quadros respiratórios brandos e além da via respiratória, eliminam o vírus pela via fecal-oral também. O MERS-CoV está muito bem adaptado aos camelos dromedários, com baixa taxa de mutação, sendo um excelente reservatório para a infecção humana. Estudos filogenéticos indicam que os coronavírus humanos HCoV-NL63 e HCoV-229E se originaram de morcegos, enquanto os coronavírus HCoV-OC43 e HCoV-HKU1, de roedores. O hospedeiro intermediário suspeito do HCoV-229E são camelídeos (alpacas), embora não se exclua a possibilidade de transmissão direta a partir do morcego. É possível a transmissão deste coronavírus humano para as alpacas, e não o inverso. Para o HCoV-OC43, os hospedeiros intermediários são os bovinos e se desconhece os hospedeiros intermediários do HCoV-NL63 e do HCoV-HKU1.
O SARS-CoV-2 possui 96% de homologia com coronavírus isolados de morcegos e até o momento, ele não deve ser considerado hospedeiro intermediário para transmissão ao homem. O(s) hospedeiro(s) intermediário(s) estaria(m) sendo vendido(s) no mercado de frutos do mar, mas animais vivos (aves e mamíferos) também estavam à venda. Aventou-se que morcegos, cobras e tartarugas seriam comercializados neste mercado, mas isto não se confirmou. Em específico no momento do surto em dezembro de 2019, os morcegos estariam em hibernação. Estudos de sequenciamento genético sugerem que os pangolins (Manis javanica) podem ser o reservatório do SARS-CoV-2. A análise do sequenciamento do domínio de ligação ao receptor da espícula S é altamente semelhante entre os beta-coronavírus de pangolim relacionados ao SARS-CoV-2.
Embora, como o genoma dos coronavírus de pangolim possuem 85 a 92% de homologia com o SARS-CoV-2, além dele ser virulento nos pangolins, ainda é pouco para constituir esta espécie como hospedeiro intermediário da infecção ao homem. Na verdade, ainda é necessário estabelecer a relação da evolução do vírus em morcegos, nos pangolins e em outro(s) mamífero(s). Aventa-se a possibilidade de recombinação do beta-coronavírus de pangolim relacionados ao SARS-CoV-2 com coronavírus de morcego resultando em outro coronavírus, infectando um suposto terceiro hospedeiro mamífero.
Foram divulgados vários relatos de gatos e cães soropositivos e/ou com RT-PCR positivos. O papel de gatos e cães em relação ao SARS-CoV-2 é o de vetor mecânico (carreadores), pouco eficiente, afinal seu pelame é uma superfície não propícia para a manutenção do vírus por muito tempo, e provavelmente são hospedeiros terminais da infecção. Demonstrou-se que eles soroconvertem ao agente, isto é, infectam-se, no entanto, não basta possuir receptor celular para permitir a entrada do agente. O SARS-CoV-2 não deve encontrar microambiente citoplasmático nas células-alvo que favoreça sua replicação, além de, provavelmente o sistema imune de gatos e cães debelarem a infecção impedindo a transmissão do agente. Assim os sintomas informados até o momento nestes relatos não foram submetidos ao adequado diagnóstico diferencial laboratorial de outras doenças infecciosas ou não, clássicas, e comumente frequentes nestas espécies. Até o momento, temos que o homem com COVID-19 contamina e infecta gatos e cães, e não o inverso. Como se busca um provável hospedeiro intermediário na cadeia de transmissão morcego/pangolim, dezenas a centenas de amostras de soros de animais de estimação (gatos e cães), animais de laboratório, animais pecuários (porcos, cavalos, bovinos e carneiros), aves domésticas (galinhas, gansos e patos) e de vários animais selvagens foram testadas para a presença de anticorpos anti-SARS-CoV-2 sem sucesso.
Algumas características relacionadas ao coronavírus facilitam a possibilidade de romper a barreira da especificidade de hospedeiro. Uma delas é a alta taxa de mutação na replicação de seu material genético pela RNA polimerase dependente de RNA e pela exoribonuclease e o tamanho imenso de seu genoma. Quanto maior for a adaptação do coronavírus em seu hospedeiro, menor será a frequência de mutações. A frequência de mutação do SARS-CoV-2 no homem é menor do que a do SARS-CoV e do MERS-CoV, assim o SARS-CoV-2 está melhor adaptado ao hospedeiro humano do que o SARS-CoV e do MERS-CoV, e isso reflete na transmissibilidade e taxa de mortalidade. O SARS-CoV-2 tem maior transmissibilidade e menor taxa de mortalidade do que o SARS-CoV e o MERS-CoV. Essa característica do SARS-CoV-2 facilita o uso promissor de antivirais e de proteção conferido por vacinas.
Algumas características relacionadas ao coronavírus facilitam a possibilidade de romper a barreira da especificidade de hospedeiro. Uma delas é a alta taxa de mutação na replicação de seu material genético pela RNA polimerase dependente de RNA e pela exoribonuclease e o tamanho imenso de seu genoma. Quanto maior for a adaptação do coronavírus em seu hospedeiro, menor será a frequência de mutações. A frequência de mutação do SARS-CoV-2 no homem é menor do que a do SARS-CoV e do MERS-CoV, assim o SARS-CoV-2 está melhor adaptado ao hospedeiro humano do que o SARS-CoV e do MERS-CoV, e isso reflete na transmissibilidade e taxa de mortalidade. O SARS-CoV-2 tem maior transmissibilidade e menor taxa de mortalidade do que o SARS-CoV e o MERS-CoV. Essa característica do SARS-CoV-2 facilita o uso promissor de antivirais e de proteção conferido por vacinas.
Outro fator importante para a transmissão interespécie é a interação dos receptores celulares e o coronavírus. O receptor que o SARS-CoV e o SARS-CoV-2 utilizam para entrar em células humanas e de vários animais é o ECA-2 (Enzima Conversora de Angiotensina 2), enquanto o vírus da MERS utiliza dipeptidil peptidase-4 (DPP4). Há uma diferença da ordem de 30% entre a sequência de aminoácidos na subunidade 1 da proteína S (espícula) do SARS-CoV e do SARS-CoV-2 que influencia na afinidade de ligação com o receptor celular ECA-2. Isto explica a maior transmissibilidade do SARS-CoV-2 por que a ligação da proteína S ao receptor ECA-2 é de 10 a 20 vezes maior. Para ocorrer infecção propriamente dita, além da entrada no interior celular via receptor, é necessário um microambiente citoplasmático favorável para que o coronavírus consiga induzir sua replicação e depois liberar suas partículas virais para transmissão. Assim, a divergência entre as proteínas do hospedeiro e o reservatório natural vai influenciar na evolução da transmissão e possibilidade de doença. Um dos pontos de restrição do novo hospedeiro ao coronavírus infectante será a resposta imune inata e adaptativa frente ao vírus. Dessa forma, para o coronavírus infectante conseguir ser capaz de ser transmitido, ele precisa entrar pelo receptor, ter condições favoráveis no citoplasma celular para a replicação e driblar a resposta do sistema imune do hospedeiro.
Este aspecto da resistência imunológica ao coronavírus é observada em morcegos, que constituem o reservatório natural destes vírus. Os morcegos não ativam adequadamente a resposta inflamatória, o que reduz o dano patológico induzido pela inflamação. Adicionalmente, a atividade de suas células “natural killer” é suprimida pela super expressão do receptor inibitório NKG2/CD94 e baixa expressão de moléculas classe I do complexo de histocompatibilidade, além de forte resposta mediada por interferon. Por outro lado, a alta taxa metabólica dos morcegos geram altos níveis de espécies reativas de oxigênio que dificultam a replicação do coronavírus, e afetam o funcionamento de sua exoribonuclease, o que leva a uma pressão de seleção para a geração de cepas mais virulentas quando introduzida em outro hospedeiro. Os coronavírus também podem ganhar maior virulência por recombinação, com a aquisição de novas proteínas durante a adaptação no hospedeiro. Nos camelos dromedários, isto também é observado; o coronavírus é pouco virulento ou desencadeia sintomatologia branda, sofrendo replicação intensa sem induzir resposta imunológica forte.
Uma grande variedade de coronavírus circulam no meio ambiente selvagem, especialmente em morcegos, roedores e pássaros. Isto proporciona a chance de recombinação e mutação deste vírus, e consequentemente a chance do aparecimento de cepas mais virulentas e transmissíveis ao homem e outros animais hospedeiros. O hábito de algumas culturas de se alimentarem de animais selvagens, além da invasão do nicho ecológico e do rompimento do equilíbrio destes locais, favorecem a infecção humana e de outros animais também. A educação em saúde, medidas higiênico-sanitárias no manuseio e preparo de carnes e derivados de animais silvestres, e a vigilância sanitária sobre mamíferos e aves, melhorará a compreensão da ecologia dos coronavírus e seus hospedeiros naturais, o que será útil na prevenção da transmissão animal ao homem em possíveis surtos futuros.
 |
Doutor Marcelo ZanuttoMédico Veterinário pela Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo em 1995. Programa de Residência em Clínica e Cirurgia de Pequenos Animais junto ao Hospital Veterinário da FMVZ-USP. Mestre e Doutor em Clínica Veterinária pela FMVZ-USP. Fez parte do Quadro Docente, no cargo de Professor Adjunto Doutor do Departamento de Patalogia e Clínicas da Escola de Medicina Veterinária da Universidade Federal da Bahia de 2002 até 2006. Faz parte do Quadro Docente, no cargo de Professor Associado Doutor do Departamento de Clínicas Veterinárias (DCV) do Centro de Ciências Agrárias (CCA) da Universidade Estadual de Londrina (UEL). |
Atenção: O conteúdo deste site é destinado exclusivamente a médicos-veterinários, profissionais qualificados para avaliar e atestar a saúde de cães e gatos durante o processo de imunização. Se você não é um médico-veterinário, procure as informações com o profissional de sua confiança.
Compartilhe esse artigo com os seus colegas profissionais veterinários!
| |
|
|
|
|---|
Saiba onde encontrar nossas vacinas:
adm-sac@zoetis.com
SAC ZOETIS: 0800 011 1919
Clique aqui para conferir outros artigos exclusivos.













